El sig. video trata de la siembra y resiembra de microorganismos en el agua....después de haber echo la toma de muestra vamos a sembrar para poder identificar los microorganismos que se encuentran en el agua de una llave q se ubica en el parque regional de colima
jueves, 11 de junio de 2009
martes, 19 de mayo de 2009
CUENTA ESTANDAR
Análisis bacteriológico del agua.
Se trata de realizar una muestra de agua del gripo, cuidando las condiciones según las Normas Oficiales Mexicanas que nos rigen, estamos mostrando imagenes, videos, así como los guiones correspondientes para una mejor comprensión.
En ésta ocasión les presentamos una parte del procedimiento, llamado Cuentan etándar, que consiste en la determinación del total de colonias que crecen en un medio nutritivo, para despiués con otro proceimiento determinar cuales de éstas son coliformes.

Se trata de realizar una muestra de agua del gripo, cuidando las condiciones según las Normas Oficiales Mexicanas que nos rigen, estamos mostrando imagenes, videos, así como los guiones correspondientes para una mejor comprensión.
En ésta ocasión les presentamos una parte del procedimiento, llamado Cuentan etándar, que consiste en la determinación del total de colonias que crecen en un medio nutritivo, para despiués con otro proceimiento determinar cuales de éstas son coliformes.

lunes, 18 de mayo de 2009
Análisis bacteriológico del agua
Toma de muestra
Antes de comenzar debemos tener todo el material esterilizado, tal y como lo indica la Norma Covenin 2614-1994 en el punto 5.2.1… Los materiales son: frasco de vidrio con tapón de rosca, bata de laboratorio, guantes, cubre bocas, cinta y papel para etiquetar el frasco, jabón y alcohol para lavar y esterilizar el frasco…
Revisar que el grifo no tenga ninguna fuga y luego quitar la rosca para lavarla con agua y jabón, como lo indica la NOM-014-SSAI-1993 en el punto 6.1.1
Para continuar debemos lavarnos las manos con agua y jabón asta los codos como lo indica el punto 6.1.2.1 en la NOM-014-SSAI-1993
Después debemos ponernos guantes, cubre bocas y bata de laboratorio esto con el fin de no contaminar la muestra (durante el proceso se debe evitar hablar)
Continuamos vertiendo alcohol sobre el grifo para flamearlo con esto hemos esterilizado para poder continuar, deberemos dejar correr el agua por tres minutos. Como esta indicado en el punto 6.1.1.2
Para tomar la muestra debemos hacerlo destapando el frasco solo en el momento y deberemos dejar un espacio de 10% vacio
Ya tomada la muestra deberemos etiquetar el frasco con los datos que son: temperatura del agua, tipo de análisis, nombre de la persona, lugar donde se tomo la muestra, hora y fecha, como lo indica el punto 8.1, 8.1.1, 8.1.2 y 8.2
Para transportar la muestra al laboratorio debemos meter la muestra a una hielera con bolsas de hielo de preferencia de una temperatura de 4º a 10ºc como lo señala el punto 7.1
El periodo máximo para transportar la muestra es de 6 hrs. Para el análisis bacteriológico como lo indica el punto 7.2.1
Toma de muestra
Antes de comenzar debemos tener todo el material esterilizado, tal y como lo indica la Norma Covenin 2614-1994 en el punto 5.2.1… Los materiales son: frasco de vidrio con tapón de rosca, bata de laboratorio, guantes, cubre bocas, cinta y papel para etiquetar el frasco, jabón y alcohol para lavar y esterilizar el frasco…
Revisar que el grifo no tenga ninguna fuga y luego quitar la rosca para lavarla con agua y jabón, como lo indica la NOM-014-SSAI-1993 en el punto 6.1.1
Para continuar debemos lavarnos las manos con agua y jabón asta los codos como lo indica el punto 6.1.2.1 en la NOM-014-SSAI-1993
Después debemos ponernos guantes, cubre bocas y bata de laboratorio esto con el fin de no contaminar la muestra (durante el proceso se debe evitar hablar)
Continuamos vertiendo alcohol sobre el grifo para flamearlo con esto hemos esterilizado para poder continuar, deberemos dejar correr el agua por tres minutos. Como esta indicado en el punto 6.1.1.2
Para tomar la muestra debemos hacerlo destapando el frasco solo en el momento y deberemos dejar un espacio de 10% vacio
Ya tomada la muestra deberemos etiquetar el frasco con los datos que son: temperatura del agua, tipo de análisis, nombre de la persona, lugar donde se tomo la muestra, hora y fecha, como lo indica el punto 8.1, 8.1.1, 8.1.2 y 8.2
Para transportar la muestra al laboratorio debemos meter la muestra a una hielera con bolsas de hielo de preferencia de una temperatura de 4º a 10ºc como lo señala el punto 7.1
El periodo máximo para transportar la muestra es de 6 hrs. Para el análisis bacteriológico como lo indica el punto 7.2.1
domingo, 17 de mayo de 2009
viernes, 31 de octubre de 2008
Coagulasa
¿Cuando se dice que un microorganismo es coagulasa positivo (+)?
En los microorganismos como el Staphilococcus se dice que son coagulasa positivo o negativo, pero ¿por qué?
Prueba de la COAGULASA: Esta prueba se utiliza para diferenciar al Staphylococcus aureus (coagulasa positivo) de otras especies del género Staphylococcus. La coagulasa es una enzima que estimula la conversión del fibrinógeno en fibrina, por lo que comprueba la facultad de un microorganismo de coagular el plasma por acción de esta enzima. Si es coagulasa positivo, se produce una turbidez alrededor de la colonia, debida a la coagulación del plasma. Por otro lado, realizamos esta prueba cultivando a las bacterias en un medio rico en manitol (además de plasma). El manitol es un azúcar y gracias a este medio podremos distinguir si el microorganismo lo utiliza como fuente de carbono. Si es capaz de usarlo, se produce una acidificación del medio, lo que da lugar a un viraje del indicador de pH de rojo a amarillo.
Staphylococcus aureus (estafilococo áureo) es una bacteria que se encuentra en la piel y fosas nasales de las personas sanas, que causa gran variedad de infecciones, desde infecciones menores de la piel (forunculos, ampollas, vejigas) y abscesos cutáneos hasta enfermedades que pueden poner en peligro la vida como neumonía, meningitis, endocarditis, síndrome del shock toxico (SST) y sepsis.
Es un coco que crece agrupado en racimos (de ahí su raíz "Staphylo"), que responde positivamente a la tinción de Gram, es aerobio y anaerobio facultativo por lo que puede crecer tanto en una atmósfera con oxígeno y también sin el mismo, no presenta movilidad ni forma cápsula. Es capaz de crecer hasta con un 10 % de sal común. Por esto puede crecer en el agua del mar. Produce la fermentación láctica. Es catalasa positivo y coagulasa positivo.
Staphylococcus aureus produce dos tipos de coagulasa, una libre y otra unida. La coagulasa libre es una enzima extracelular producida cuando el microorganismo es cultivado en caldo. La coagulasa unida, también conocida como factor de aglutinación, permanece unida a la pared celular de la bacteria.
Los estafilococos coagulasa-negativo son las bacterias mas comúnmente aisladas en los laboratorios microbiológicos
(1). Entre ellos el S. epidermidis, que se caracteriza por ser coagulasa negativo y novobiacina sensible, fue considerado por mucho tiempo como un germen contaminante de cultivos. Sin embargo, ahora se le reconoce como un patógeno importante
(2) y es considerado el agente causal de diferentes entidades clínicas, entre ellas: Infecciones urinarias intrahospitalarias, osteomielitis, endocarditis de válvula nativa, bacteremia en pacientes inmunosuprimidos, endoftalmitis después de cirugía ocular, infecciones de dispositivos médicos o cuerpos extraños (catéteres endovenosos, fístulas para hemodiálisis, catéteres de diálisis peritoneal, marcapasos, articulaciones protésicas, injertos vasculares, válvulas cardiacas protésicas e implantes de mama)
(3). Otra característica importante de esta bacteria es la susceptibilidad antimicrobiana que presenta, ya que el S. epidermidis ha desarrollado resistencia a la meticilina en forma paralela al desarrollo de resistencia del S. aureus, pero mostrando tasas mucho mas elevadas que esta última, y que ha ido incrementándose de manera importante en los últimos 20 años. Mientras que a inicio de los ´80s se indicaban tasas de resistencia a la meticilina del 20%, en 1999 estas llegaron al 80%
(4). Esta es la razón por la cual en la actualidad se considera que la vancomicina es el tratamiento de elección para las infecciones causadas por este germen
(3).Se presenta el caso de un paciente que desarrolló bacteremia por S. epidermidis asociado a un absceso de partes blandas en el post operatorio, el cual respondió favorablemente al tratamiento con vancomicina.
En los microorganismos como el Staphilococcus se dice que son coagulasa positivo o negativo, pero ¿por qué?
Prueba de la COAGULASA: Esta prueba se utiliza para diferenciar al Staphylococcus aureus (coagulasa positivo) de otras especies del género Staphylococcus. La coagulasa es una enzima que estimula la conversión del fibrinógeno en fibrina, por lo que comprueba la facultad de un microorganismo de coagular el plasma por acción de esta enzima. Si es coagulasa positivo, se produce una turbidez alrededor de la colonia, debida a la coagulación del plasma. Por otro lado, realizamos esta prueba cultivando a las bacterias en un medio rico en manitol (además de plasma). El manitol es un azúcar y gracias a este medio podremos distinguir si el microorganismo lo utiliza como fuente de carbono. Si es capaz de usarlo, se produce una acidificación del medio, lo que da lugar a un viraje del indicador de pH de rojo a amarillo.
Staphylococcus aureus (estafilococo áureo) es una bacteria que se encuentra en la piel y fosas nasales de las personas sanas, que causa gran variedad de infecciones, desde infecciones menores de la piel (forunculos, ampollas, vejigas) y abscesos cutáneos hasta enfermedades que pueden poner en peligro la vida como neumonía, meningitis, endocarditis, síndrome del shock toxico (SST) y sepsis.
Es un coco que crece agrupado en racimos (de ahí su raíz "Staphylo"), que responde positivamente a la tinción de Gram, es aerobio y anaerobio facultativo por lo que puede crecer tanto en una atmósfera con oxígeno y también sin el mismo, no presenta movilidad ni forma cápsula. Es capaz de crecer hasta con un 10 % de sal común. Por esto puede crecer en el agua del mar. Produce la fermentación láctica. Es catalasa positivo y coagulasa positivo.
Staphylococcus aureus produce dos tipos de coagulasa, una libre y otra unida. La coagulasa libre es una enzima extracelular producida cuando el microorganismo es cultivado en caldo. La coagulasa unida, también conocida como factor de aglutinación, permanece unida a la pared celular de la bacteria.
Los estafilococos coagulasa-negativo son las bacterias mas comúnmente aisladas en los laboratorios microbiológicos
(1). Entre ellos el S. epidermidis, que se caracteriza por ser coagulasa negativo y novobiacina sensible, fue considerado por mucho tiempo como un germen contaminante de cultivos. Sin embargo, ahora se le reconoce como un patógeno importante
(2) y es considerado el agente causal de diferentes entidades clínicas, entre ellas: Infecciones urinarias intrahospitalarias, osteomielitis, endocarditis de válvula nativa, bacteremia en pacientes inmunosuprimidos, endoftalmitis después de cirugía ocular, infecciones de dispositivos médicos o cuerpos extraños (catéteres endovenosos, fístulas para hemodiálisis, catéteres de diálisis peritoneal, marcapasos, articulaciones protésicas, injertos vasculares, válvulas cardiacas protésicas e implantes de mama)
(3). Otra característica importante de esta bacteria es la susceptibilidad antimicrobiana que presenta, ya que el S. epidermidis ha desarrollado resistencia a la meticilina en forma paralela al desarrollo de resistencia del S. aureus, pero mostrando tasas mucho mas elevadas que esta última, y que ha ido incrementándose de manera importante en los últimos 20 años. Mientras que a inicio de los ´80s se indicaban tasas de resistencia a la meticilina del 20%, en 1999 estas llegaron al 80%
(4). Esta es la razón por la cual en la actualidad se considera que la vancomicina es el tratamiento de elección para las infecciones causadas por este germen
(3).Se presenta el caso de un paciente que desarrolló bacteremia por S. epidermidis asociado a un absceso de partes blandas en el post operatorio, el cual respondió favorablemente al tratamiento con vancomicina.
CULTIVO DE BACTERIAS
Maestra: Janet Pineda Rincon
Integrantes del Equipo:
Mauro Alberto Martell Vargas
Marisa M. Sandoval Perez
Paola Lilian Esquivel Blanco
Mercedes Estefania Carrillo Escoto
Lizette Mendez Moreno
Materia: Identificar Microorganismos a traves de Analisis Microbiologicos
Fecha de Entrega: 31/Oct/08
Grado y Grupo: 3n Laboratorista Quimico
Cbtis 19 Colima
Introducción
RECOLECCION DE MUESTRAS
La correcta recolección de una muestra para su cultivo es posiblemente la etapa mas importante en el aislamiento de microorganismos responsables de enfermedades infecciosas, una muestra deficientemente recogida puede ser el fracaso de asilar el microorganismo causante y la recuperación de contaminantes puede conducir a una terapia incorrecta o perjudicad por ejemplo; supongamos que se a aislado KLEBSIELLA PNEUMONIAE de esputo de un paciente con neumonía clínica, si el esputo a sido incorrectamente recogido y consiste en realidad de saliva, la KLEBSIELLA PNEUMONIAE puede representar que en ambiente comensal de zonas nasales, orificios nasales, o faringe posterior, y puede no reflejar la verdadera causa de la neumonía.
La muestra para cultivo debe ser material del verdadero sitio de infección y debe recoger con mínimo de contaminación de tejidos, órganos o secreciones adyacentes.
1.- INCULO PRIMARIO.
Se puede efectuar con un hisopo con otros dispositivos, una ve z hecho el inculo y se disemina la muestra para ello se emplea un alambre recto o asa, diseminar en los 4 cuadrantes de la caja.
El inculo se disemina sucesivamente en estrías con un movimiento de arriba y abajo en cada cuadrante dando vuelta a la placa en ángulos de 90° el alambre debe esterilizarse en las sucesivas estrías.
El propósito de esta técnica es diluir el inoculo suficientemente sobre la superficie del agar, como para poder obtener colonias bacterianas bien aisladas a partir de unidades formadas de colonias ( UFC).
Las colonias aisladas se pueden luego subcultivar individualmente transfiriéndolas a otros medios estudiados en medios diferenciales.
La técnica de estrías empieza para inocular medios de agar para el recuento semicuantitativo se efectúa:
RECOLECCION DE MUESTRAS
La correcta recolección de una muestra para su cultivo es posiblemente la etapa mas importante en el aislamiento de microorganismos responsables de enfermedades infecciosas, una muestra deficientemente recogida puede ser el fracaso de asilar el microorganismo causante y la recuperación de contaminantes puede conducir a una terapia incorrecta o perjudicad por ejemplo; supongamos que se a aislado KLEBSIELLA PNEUMONIAE de esputo de un paciente con neumonía clínica, si el esputo a sido incorrectamente recogido y consiste en realidad de saliva, la KLEBSIELLA PNEUMONIAE puede representar que en ambiente comensal de zonas nasales, orificios nasales, o faringe posterior, y puede no reflejar la verdadera causa de la neumonía.
La muestra para cultivo debe ser material del verdadero sitio de infección y debe recoger con mínimo de contaminación de tejidos, órganos o secreciones adyacentes.
1.- INCULO PRIMARIO.
Se puede efectuar con un hisopo con otros dispositivos, una ve z hecho el inculo y se disemina la muestra para ello se emplea un alambre recto o asa, diseminar en los 4 cuadrantes de la caja.
El inculo se disemina sucesivamente en estrías con un movimiento de arriba y abajo en cada cuadrante dando vuelta a la placa en ángulos de 90° el alambre debe esterilizarse en las sucesivas estrías.
El propósito de esta técnica es diluir el inoculo suficientemente sobre la superficie del agar, como para poder obtener colonias bacterianas bien aisladas a partir de unidades formadas de colonias ( UFC).
Las colonias aisladas se pueden luego subcultivar individualmente transfiriéndolas a otros medios estudiados en medios diferenciales.
La técnica de estrías empieza para inocular medios de agar para el recuento semicuantitativo se efectúa:
Se utilizan asas de platino caliente para inocular 0.01 o 0.001 mililitros de liquido se sumergen en una muestra de orina no centrifugada y se aplican en una sola estría que cruce el centro de la placa de agar.
El inoculo se disemina uniformemente en Angulo recto a la estría principal luego la placa se voltea en Angulo de 90° y se disemina en inoculo hasta cubrir toda la superficie del agar.
Substancias :
Agua destilada
Agar Mac Konkey
Agar Manitol
Agar Sangre
Fenol
Agua
Material:
Mecheros 3
Matraz Aforado
Algodón
3Vidiros de Reloj
1 Espátula
Papel para esterilizar
Probeta Graduada
Autoclave Jabón
Hisopos
Incubadora
Medidor de ph
PROCEDIMIENTO
Pesamos cada vidrio de reloj, utilizamos la regla de 3 con el fin de saber cuanto agar vamos a necesitar, después añadimos los 3 tipos de agar ( Sangre, Manitol, Mac Konkey), luego lavamos bien los 3 matrazases y los calentamos sobre el mechero para secarlos, después etiquetamos el matraz con el nombre del agar que corresponde a cada uno,
Con una probeta graduada medimos la cantidad de agua destilada que vamos a usar, y vertemos el agua que vamos a utilizar, depuse lo llevamos al fuego para desbaratar los grumos.
Luego se mide el ph con un indicador que sea el indicado.
Para hacer los tapones necesitamos algodón, un trozo de gasa colocamos 2 hileras de 5 bolitas de algodón y los cubrimos con la gasa y un poco de cinta testigo
Para desbaratar los grumos de las agares colocamos los tapones y los forramos con el papel y un trozo de cinta
Después envolvimos las cajas petri previamente lavadas y secadas, las forramos con papel para esterilizar y utilizamos cinta testigo.
Después los metimos al Autoclave y los empezamos a esterilizar con calor húmedo a 15 libras de presión de vapor por 15 minutos,
Ya pasados los 15 minutos retiramos los materiales del autoclave, y desinfectamos la mesa de trabajo, primero la lavamos rigurosamente con agua enjabonada, retiramos el exceso y la cubrimos de Fenol, ya terminado el proceso de desinfección de la mesa, conectamos los mecheros. Una vez terminado esto, acomodamos los materiales.
Para preparar el agar sangre, necesitamos que un miembro del equipo donara sangre, una vez que le sacamos la sangre, llevamos la temperatura del matraz con al agar al la temperatura corporal que es de 37° A 35° ,esto con el fin de que no se coagule la sangre dentro del matraz, ya finalizado este procesábamos a la mesa de trabajo y permanecemos callados todo con el fin de evitar que microorganismos extraños en los agares, empezamos a verter los agares en las cajas petri con los mecheros bien encendidos, ya que vertamos al agar pasamos el mechero sobre las cajas para eliminar las burbujas que se hayan formado.
Después esperamos a que el agar se solidifique para empezar a cultivar,
La muestra la tomamos de la garganta de un compañero con in hisopo ya estéril, después procedimos a colocar un poco de bacterias en una orillita de la caja primero el mac koncay, manitol y el sangre lo dejamos al ultimo porque la mayoría de bacterias quedarían hay, después en el mechero ponemos el Haza para que se esterilice (que se ponga al rojo vivo) y luego enfriamos el asa en un ladito entre la caja y el agar y tenemos que recordar en donde colocamos la muestra de la garganta arrastramos con el asa en forma de estrías hasta la mitad, llevamos el asa nuevamente al fuego y nuevamente arrastramos bacterias nuevamente asiendo estrías y así sucesiva mente en los cuatro cuadrantes en las tres cajas.
Luego los tapamos, etiquetamos y metemos ala incubadora, y lo revisamos cada 24, 48 o 72 horas si creció alguna bacteria luego se hace l reporte de lo que observamos
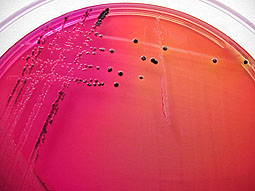
*AGAR SANGRE:
En este agar a las 24 horas se presentaron cambios mínimos, se formaron pequeñas colonias de staphilococos que son los círculos grandes, y muchas colonias de staphilococos que son los círculos mas pequeños.
A las 72 horas la cantidad de streptococos aumento poco.
AGAR MANITOL
A las 24 horas hubo solo 2 colonias de Staphilococos Aureos.
A las 72 horas la cantidad se triplico y se formo una nueva colonia de Staphilococos Epidermis.
A las 24 horas hubo solo 2 colonias de Staphilococos Aureos.
A las 72 horas la cantidad se triplico y se formo una nueva colonia de Staphilococos Epidermis.
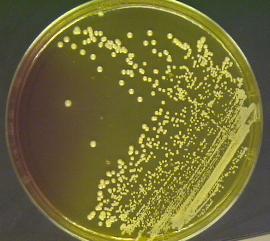
AGAR MAC KONKEY
No hubo ningun cabio en el, ni a las 24 horas, ni alas 72 horas, debido a que solo crecen bacterias gram
TINCION GRAM:
Tomamos el asa la esterilizamos calentándola al rojo vivo, la dejamos enfriar y tomamos la muestra de bacterias de las cajas y la colocamos en un porta objetos y luego sellamos la muestra al porta objetos, se le agrega una gota de azul de metileno, una vez aplicado el azul, esperamos 1 minuto y enjuagamos gota a gota, después lo dejamos secar, una vez seco añadimos un poco de mordiente que vendría siendo el yodo lugol, enjuagamos de nuevo gota a gota y dejamos secar nuevamente, luego aplicamos unas gotas de safranina, y la dejamos secar por 1 minuto, luego enjuagamos como se indico y dejamos secar nuevamente, y después nos fuimos a observar en el microscopio
Esto fue lo que observamos
EN EL SANGRE
Observamos los
*staphilococos: su morfología de colonia es: su tamaño es mm, su elevación es umbilicada, su color esta entre blanco y amarillo su superficie es mate.
*diplococos: su morfología colonial es: tamaño mm, su forma es circular, su elevación es convecsa, su margen es entero, su color esta entre negro y blanco, su superficie es brillante.
*cocos: su morfología de colonia es: tamaño es mm, su forma es puntiforme, su elevación es plano, su color es negro, su superficie es mate.
El staphilococos esta en grandes colonias y diplococos al igual que el cocos estan en pequeñas colonias.

Suscribirse a:
Entradas (Atom)